Skandio, kun elementa simbolo Sc kaj atomnumero 21, estas facile solvebla en akvo, povas interagi kun varma akvo, kaj facile malheliĝas en la aero. Ĝia ĉefa valenco estas +3. Ĝi ofte miksiĝas kun gadolinio, erbio, kaj aliaj elementoj, kun malalta rendimento kaj enhavo de proksimume 0.0005% en la krusto. Skandio ofte uziĝas por fari specialan vitron kaj malpezajn alttemperaturajn alojojn.
Nuntempe, la pruvitaj rezervoj de skandio en la mondo estas nur 2 milionoj da tunoj, el kiuj 90~95% troviĝas en baŭksito, fosforito kaj fero-titanio-ercoj, kaj malgranda parto en uranio-, torio-, volframo- kaj rarateraj ercoj, ĉefe distribuitaj en Rusio, Ĉinio, Taĝikio, Madagaskaro, Norvegio kaj aliaj landoj. Ĉinio estas tre riĉa je skandiaj resursoj, kun grandegaj mineralaj rezervoj rilataj al skandio. Laŭ nekompletaj statistikoj, la rezervoj de skandio en Ĉinio estas ĉirkaŭ 600 000 tunoj, kiuj troviĝas en baŭksito- kaj fosforito-deponejoj, porfiro- kaj kvarcvejno-volframo-deponejoj en Suda Ĉinio, rarateraj deponejoj en Suda Ĉinio, Bayan Obo raratera fererco-deponejo en Interna Mongolio, kaj Panzhihua vanado-titanio-magnetita deponejo en Siĉuano.
Pro la malabundeco de skandio, la prezo de skandio ankaŭ estas tre alta, kaj ĉe sia pinto, la prezo de skandio estis ŝveligita al 10-obla prezo de oro. Kvankam la prezo de skandio malaltiĝis, ĝi ankoraŭ estas kvar-obla prezo de oro!
Malkovrante Historion
En 1869, Mendeleev rimarkis interspacon en atommaso inter kalcio (40) kaj titanio (48), kaj antaŭdiris, ke ankaŭ tie troviĝas nemalkovrita meza atommasa elemento. Li antaŭdiris, ke ĝia oksido estas X₂OÅ. Skandio estis malkovrita en 1879 de Lars Frederik Nilson de la Universitato de Upsalo en Svedio. Li ekstraktis ĝin el la nigra rara orminejo, kompleksa erco, kiu enhavas 8 tipojn de metaloksidoj. Li ekstraktisErbio(III) oksidoel nigra rara orerco, kaj akiritaIterbio(III) oksidode ĉi tiu oksido, kaj ekzistas alia oksido de pli malpeza elemento, kies spektro montras, ke ĝi estas nekonata metalo. Ĉi tiu estas la metalo antaŭdirita de Mendeleev, kies oksido estasSc₂O₃La skandio-metalo mem estis produktita elSkandia kloridoper elektroliza fandado en 1937.
Mendeleev
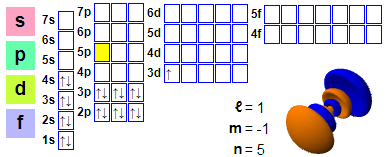
Elektrona konfiguracio
Elektrona konfiguracio: 1s² 2s² 2p6 3s² 3p6 4s² 3d1
Skandio estas mola, arĝentblanka transirmetalo kun fandopunkto de 1541 ℃ kaj bolpunkto de 2831 ℃.
Dum konsiderinda tempodaŭro post ĝia malkovro, la uzo de skandio ne estis montrita pro ĝia malfacileco en produktado. Kun la kreskanta plibonigo de metodoj por apartigi rarajn terojn, nun ekzistas matura procezfluo por purigi skandiajn kombinaĵojn. Ĉar skandio estas malpli alkala ol itrio kaj lantanido, la hidroksido estas la plej malforta, do la miksita mineralo enhavanta rarajn terojn en skandio estos apartigita de la rara tera elemento per la metodo de "ŝtupa precipitado" kiam skandia(III) hidroksido estas traktita per amoniako post translokigo en solvaĵon. La alia metodo estas apartigi skandian nitraton per polusa malkomponiĝo de nitrato. Ĉar skandia nitrato estas la plej facile malkomponebla, skandio povas esti apartigita. Krome, la ampleksa reakiro de akompananta skandio el uranio, torio, volframo, stano kaj aliaj mineralaj deponaĵoj ankaŭ estas grava fonto de skandio.
Post akiro de pura skandia kombinaĵo, ĝi estas konvertita en ScCl3Å kaj kunfandita kun KCl kaj LiCl. La fandita zinko estas uzata kiel katodo por elektrolizo, kaŭzante skandion precipitaĵon sur la zinka elektrodo. Poste, la zinko estas vaporigita por akiri metalan skandion. Ĉi tio estas malpeza arĝenta blanka metalo kun tre aktivaj kemiaj ecoj, kiu povas reagi kun varma akvo por generi hidrogenan gason. Do la metala skandio, kiun vi vidas en la bildo, estas sigelita en botelo kaj protektita per argona gaso, alie skandio rapide formos malhelflavan aŭ grizan oksidan tavolon, perdante sian brilan metalan brilon.
Aplikoj
Lumiga industrio
La uzoj de skandio koncentriĝas en tre helaj direktoj, kaj ne estas troigo nomi ĝin la Filo de Lumo. La unua magia armilo de skandio nomiĝas skandia-natria lampo, kiu povas esti uzata por lumigi milojn da hejmoj. Ĉi tio estas metal-halogenida elektra lumo: la bulbo estas plenigita per natria jodido kaj skandia trijodido, kaj skandio kaj natria folio estas aldonitaj samtempe. Dum alt-tensia malŝarĝo, skandiaj jonoj kaj natriaj jonoj respektive elsendas lumon de siaj karakterizaj emisiaj ondolongoj. La spektraj linioj de natrio estas 589.0 kaj 589.6 nm, du famaj flavaj lumoj, dum la spektraj linioj de skandio estas 361.3~424.7 nm, serio de preskaŭ ultraviola kaj blua lumemisioj. Ĉar ili kompletigas unu la alian, la ĝenerala produktita lumkoloro estas blanka lumo. Ĝuste ĉar skandiaj natriaj lampoj havas la karakterizaĵojn de alta lumefikeco, bona lumkoloro, energiŝparo, longa servodaŭro kaj forta nebulorompa kapablo, ili povas esti vaste uzataj por televidkameraoj, placoj, sportejoj kaj vojlumigo, kaj estas konataj kiel la triageneraciaj lumfontoj. En Ĉinio, ĉi tiu tipo de lampo iom post iom estas reklamata kiel nova teknologio, dum en iuj evoluintaj landoj, ĉi tiu tipo de lampo estis vaste uzata jam en la fruaj 1980-aj jaroj.
La dua magia armilo de skandio estas sunaj fotovoltaecaj ĉeloj, kiuj povas kolekti la lumon disĵetitan sur la teron kaj transformi ĝin en elektron por funkciigi homan socion. Skandio estas la plej bona barilmetalo en metalaj izoliloj, duonkonduktaĵoj, siliciaj sunĉeloj kaj sunĉeloj.
Ĝia tria magia armilo nomiĝas γ-radia fonto. Ĉi tiu magia armilo povas brili hele memstare, sed ĉi tiu speco de lumo ne povas esti ricevita per la nuda okulo, ĝi estas alt-energia fotonfluo. Ni kutime ekstraktas 45Sc el mineraloj, kiu estas la sola natura izotopo de skandio. Ĉiu 45Sc-nukleo enhavas 21 protonojn kaj 24 neŭtronojn. 46Sc, artefarita radioaktiva izotopo, povas esti uzata kiel γ-radiadaj fontoj aŭ spuraj atomoj, kiuj ankaŭ povas esti uzataj por radioterapio de malignaj tumoroj. Ekzistas ankaŭ aplikoj kiel itrio-galio-skandio-granata lasero.Skandia fluoridovitro infraruĝa optika fibro, kaj skandio-kovrita katodradia tubo en televido. Ŝajnas, ke skandio naskiĝas kun brileco.
Alojindustrio
Skandio en sia elementa formo estas vaste uzata por dopi aluminiajn alojojn. Kondiĉe ke kelkaj milonoj da skandio estas aldonitaj al aluminio, nova Al3Sc-fazo formiĝos, kiu ludos metamorfisman rolon en la aluminia alojo kaj ŝanĝos signife la strukturon kaj ecojn de la alojo. Aldono de 0.2%~0.4% da Sc (kio estas vere simila al la proporcio de aldono de salo al hejmaj frititaj legomoj, nur iomete necesas) povas pliigi la rekristaliĝan temperaturon de la alojo je 150-200 ℃, kaj signife plibonigi alt-temperaturan forton, strukturan stabilecon, veldan rendimenton kaj korodreziston. Ĝi ankaŭ povas eviti la rompiĝeman fenomenon, kiu facile okazas dum longdaŭra laboro je altaj temperaturoj. Alt-forta kaj alt-teneca aluminia alojo, nova alt-forta korod-rezista veldebla aluminia alojo, nova alt-temperatura aluminia alojo, alt-forta neŭtron-surradiada rezista aluminia alojo, ktp., havas tre allogajn disvolviĝajn perspektivojn en aerspaca, aviada, ŝipoj, nukleaj reaktoroj, malpezaj veturiloj kaj rapidtrajnoj.
Skandio estas ankaŭ bonega modifaĵo por fero, kaj malgranda kvanto da skandio povas signife plibonigi la forton kaj malmolecon de gisfero. Krome, skandio ankaŭ povas esti uzata kiel aldonaĵo por alttemperaturaj volframaj kaj kromaj alojoj. Kompreneble, krom la fabrikado de geedziĝaj vestaĵoj por aliaj, skandio havas altan fandopunkton kaj ĝia denseco similas al aluminio, kaj ankaŭ estas uzata en altfandopunktaj malpezaj alojoj kiel skandia titana alojo kaj skandia magnezia alojo. Tamen, pro ĝia alta prezo, ĝi ĝenerale estas uzata nur en altkvalitaj fabrikadaj industrioj kiel kosmopramoj kaj raketoj.
Ceramika materialo
Skandio, unuopa substanco, estas ĝenerale uzata en alojoj, kaj ĝiaj oksidoj ludas gravan rolon en ceramikaj materialoj simile. La tetragona zirkonia ceramika materialo, kiu povas esti uzata kiel elektroda materialo por solidaj oksidaj fuelpiloj, havas unikan econ, kie la konduktiveco de ĉi tiu elektrolito pliiĝas kun kreskanta temperaturo kaj oksigena koncentriĝo en la ĉirkaŭaĵo. Tamen, la kristala strukturo de ĉi tiu ceramika materialo mem ne povas ekzisti stabile kaj havas neniun industrian valoron; necesas dopi iujn substancojn, kiuj povas fiksi ĉi tiun strukturon, por konservi ĝiajn originalajn ecojn. Aldoni 6~10% da skandia oksido similas al betona strukturo, tiel ke zirkonio povas esti stabiligita sur kvadrata krado.
Ekzistas ankaŭ inĝenieraj ceramikaj materialoj kiel ekzemple alt-fortaj kaj alt-temperatur-rezistaj siliciaj nitridoj kiel densigiloj kaj stabiligiloj.
Kiel densigilo,Skandia oksidopovas formi obstinan fazon Sc2Si2O7 ĉe la rando de fajnaj partikloj, tiel reduktante la alttemperaturan deformadon de inĝenieraj ceramikaĵoj. Kompare kun aliaj oksidoj, ĝi povas pli bone plibonigi la alttemperaturajn mekanikajn ecojn de silicia nitrido.
Kataliza kemio
En kemia inĝenierarto, skandio ofte estas uzata kiel katalizilo, dum Sc₂O₃ povas esti uzata por dehidratigo kaj deoksidigo de etanolo aŭ izopropanolo, malkomponiĝo de acetata acido, kaj produktado de etileno el CO kaj H₂. La Pt-Al-katalizilo enhavanta Sc₂O₃ estas ankaŭ grava katalizilo por hidrogenigaj, purigaj kaj rafinadaj procezoj de peza oleo en la petrolkemia industrio. En katalizaj fendaj reagoj kiel ekzemple kumeno, la aktiveco de Sc-Y-zeolita katalizilo estas 1000-oble pli alta ol tiu de aluminio-silikata katalizilo; Kompare kun iuj tradiciaj kataliziloj, la disvolviĝaj perspektivoj de skandiaj kataliziloj estos tre brilaj.
Nuklea energia industrio
Aldoni malgrandan kvanton da Sc2O3 al UO2 en alttemperatura reaktora nuklea fuelo povas eviti kradtransformon, volumenpliiĝon kaj fendetiĝojn kaŭzitajn de la konverto de UO2 al U3O8.
Fuelpilo
Simile, aldoni 2,5% ĝis 25% da skandio al nikelaj alkalaj baterioj plilongigos ilian servodaŭron.
Agrikultura bredado
En agrikulturo, semoj kiel maizo, beto, pizo, tritiko kaj sunfloro povas esti traktataj per skandia sulfato (la koncentriĝo estas ĝenerale 10⁻³~10⁻⁸ mol/L, malsamaj plantoj havos malsamajn rezultojn), kaj la efektiva efiko de antaŭenigado de ĝermado estas atingita. Post 8 horoj, la seka pezo de radikoj kaj burĝonoj pliiĝis je 37% kaj 78% respektive kompare kun plantidoj, sed la mekanismo ankoraŭ estas studata.
De la atento de Nielsen al la ŝuldo de atommasaj datumoj ĝis hodiaŭ, skandio eniris la vizion de homoj nur dum cent aŭ dudek jaroj, sed ĝi preskaŭ sidis sur la benko dum cent jaroj. Nur kun la vigla disvolviĝo de materialscienco fine de la pasinta jarcento ĝi alportis al li viglecon. Hodiaŭ, raraj teraj elementoj, inkluzive de skandio, fariĝis varmaj steluloj en materialscienco, ludante konstante ŝanĝiĝantajn rolojn en miloj da sistemoj, alportante pli da komforto al niaj vivoj ĉiutage, kaj kreante ekonomian valoron, kiun estas eĉ pli malfacile mezuri.
Afiŝtempo: 29-a de junio 2023